Context și designul studiului
Retatrutida (LY3437943) este un nou medicament cu o singură peptidă care activeazătrei receptori simultanGIP, GLP-1 și glucagon. Pentru a evalua eficacitatea și siguranța sa la persoanele cu obezitate, dar fără diabet, a fost efectuat un studiu clinic de fază 2, randomizat, dublu-orb, controlat cu placebo (NCT04881760). Un total de338 de participanțicu un IMC ≥30 sau ≥27 cu cel puțin o comorbiditate legată de greutate, au fost randomizați pentru a primi placebo sau retatrutidă (1 mg, 4 mg cu două scheme de creștere a dozei, 8 mg cu două scheme de creștere a dozei sau 12 mg) administrată o dată pe săptămână prin injecție subcutanată timp de 48 de săptămâni.criteriu de evaluare principala fost modificarea procentuală a greutății corporale la 24 de săptămâni, criteriile de evaluare secundare incluzând modificarea greutății la 48 de săptămâni și praguri categorice de pierdere în greutate (≥5%, ≥10%, ≥15%).
Rezultate cheie
-
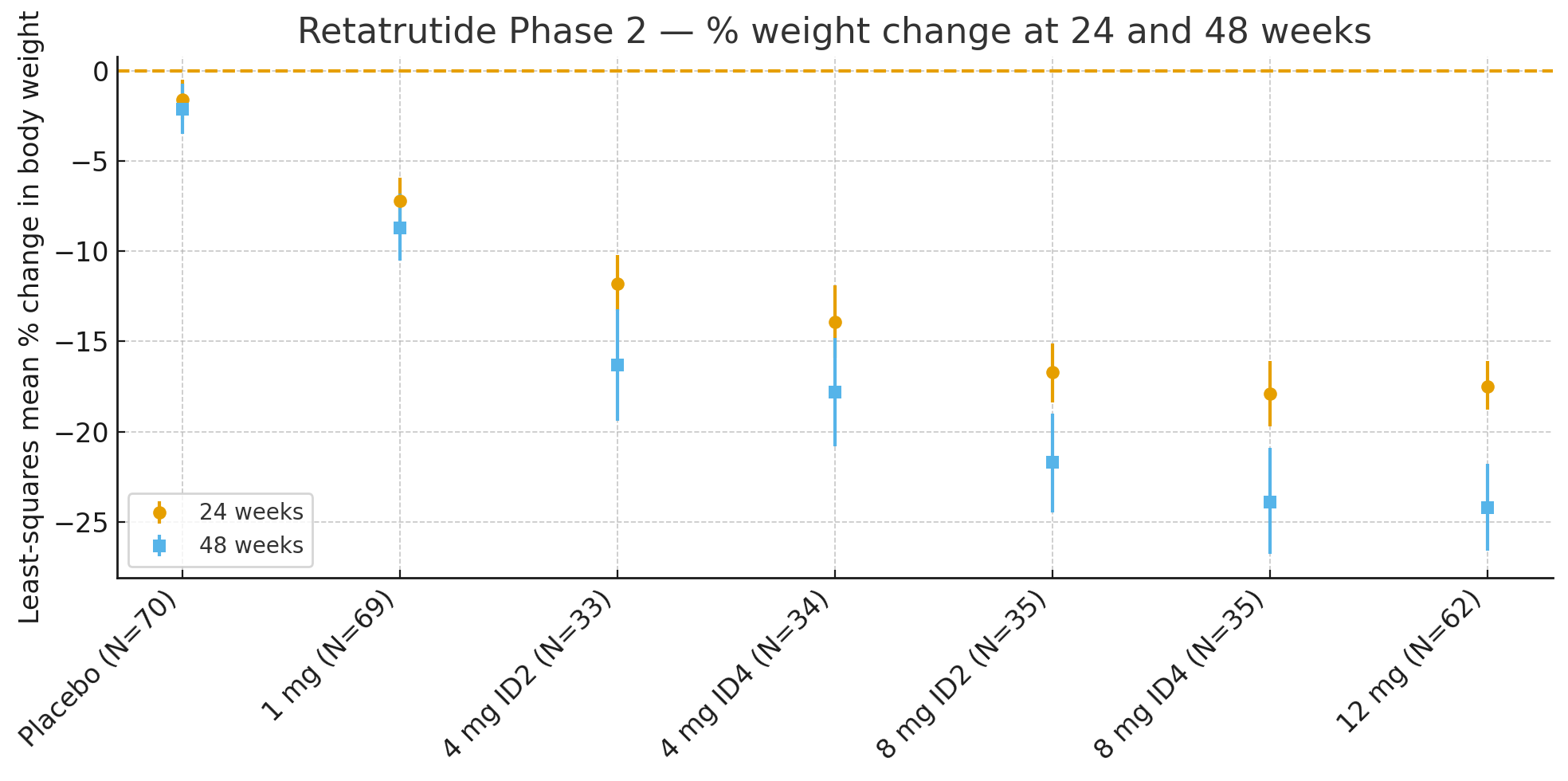
24 de săptămâniModificarea procentuală medie a greutății corporale față de valoarea inițială, bazată pe metoda celor mai mici pătrate, a fost
-
Placebo: −1,6%
-
1 mg: −7,2%
-
4 mg (combinate): −12,9%
-
8 mg (combinate): −17,3%
-
12 mg: −17,5%
-
-
48 de săptămâniModificarea procentuală a greutății corporale a fost
-
Placebo: −2,1%
-
1 mg: −8,7%
-
4 mg (combinate): −17,1%
-
8 mg (combinate): −22,8%
-
12 mg: −24,2%
-
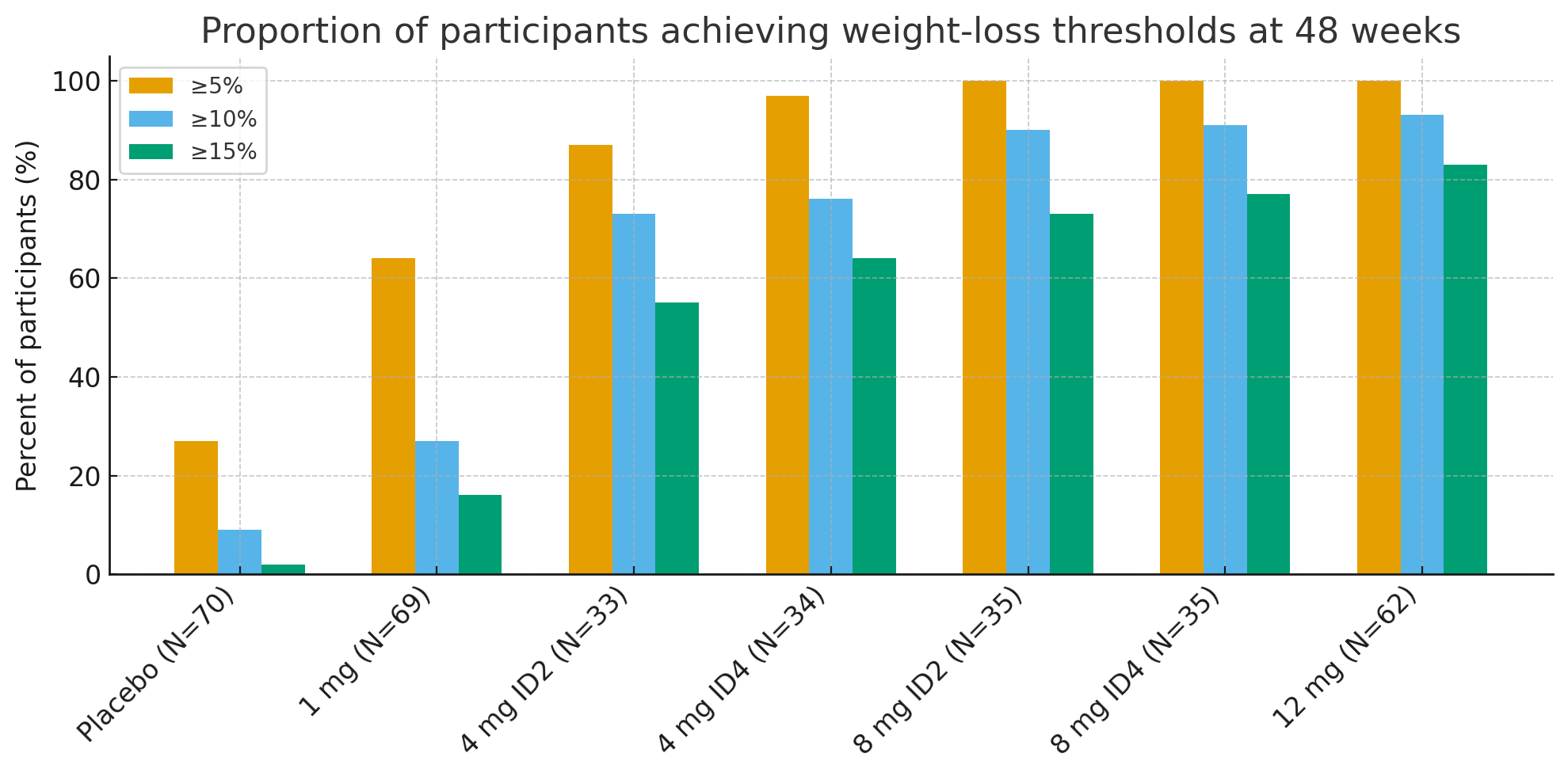
La 48 de săptămâni, proporțiile participanților care au atins praguri de pierdere în greutate semnificative clinic au fost izbitoare:
-
Pierdere în greutate ≥5%: 27% cu placebo față de 92–100% în grupurile active
-
≥10%: 9% cu placebo față de 73–93% în grupurile active
-
≥15%: 2% cu placebo față de 55–83% în grupurile active
În grupul de 12 mg, până la26% dintre participanți au pierdut ≥30% din greutatea inițială, o magnitudine a pierderii în greutate comparabilă cu cea a chirurgiei bariatrice.
Siguranţă
Cele mai frecvente evenimente adverse au fost gastrointestinale (greață, vărsături, diaree), în general ușoare până la moderate și legate de doză. Dozele inițiale mai mici (creșterea treptată a tratamentului cu 2 mg) au redus aceste evenimente. S-au observat creșteri ale ritmului cardiac legate de doză, atingând un vârf în săptămâna 24, apoi scăzând. Ratele de întrerupere au variat între 6 și 16% în cadrul grupurilor active, ceva mai mari decât în cazul placebo.
Concluzii
La adulții cu obezitate fără diabet, retatrutida administrată subcutanat săptămânal timp de 48 de săptămâni a produsreduceri substanțiale, dependente de doză, ale greutății corporale(pierdere medie de până la ~24% la cea mai mare doză), împreună cu îmbunătățiri ale markerilor cardiometabolici. Evenimentele adverse gastrointestinale au fost frecvente, dar gestionabile prin creșterea treptată a dozei. Aceste constatări ale studiului de fază 2 sugerează că retatrutida ar putea reprezenta un nou criteriu terapeutic de referință pentru obezitate, în așteptarea confirmării în studii clinice de fază 3, pe termen lung, mai ample.
Data publicării: 28 septembrie 2025